Закон Клапейрона-Менделеева – один из основных законов физической химии, который связывает давление, объем и температуру газовой смеси. Он был установлен независимо друг от друга французским ученым Бенжаменом Французским балагуром Закаром Клапейроном и русским химиком Дмитрием Ивченко Ивановичем Менделеевым.
Закон Клапейрона-Менделеева может быть записан в виде уравнения:
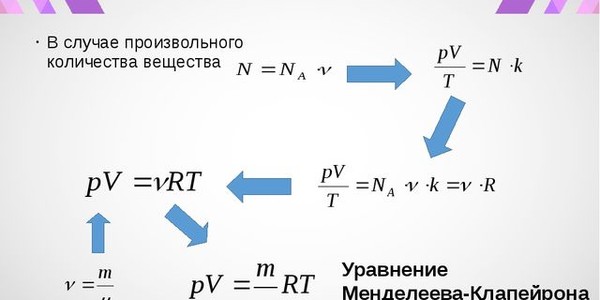
PV = nRT
где P – давление газа, V – его объем, T – температура, n – количество вещества газа, а R – универсальная газовая постоянная. Это уравнение выражает зависимость между физическими свойствами газа и количеством вещества, а также позволяет предсказывать изменения в этих свойствах при изменении одного из параметров.
Закон Клапейрона-Менделеева имеет большое значение для изучения поведения газов и находит применение в различных областях науки и техники, включая физику, химию, материаловедение и другие. Он позволяет рассчитывать состояние и свойства газа при различных условиях и проводить теоретические исследования, прогнозирование и оптимизацию процессов, связанных с газообразными веществами.
Что такое закон Клапейрона-Менделеева и его значение для химии?
Закон гласит, что для идеального газа справедливо следующее уравнение:
P * V = n * R * T
где:
- P — давление газа
- V — объем газа
- n — количество вещества газа
- R — универсальная газовая постоянная
- T — температура газа
Значение закона Клапейрона-Менделеева заключается в том, что он позволяет описывать и предсказывать свойства газов при различных условиях. Уравнение также позволяет определить изменение одной переменной при изменении других переменных.
Закон Клапейрона-Менделеева имеет большое значение для химии, поскольку позволяет установить связь между давлением, объемом, количеством вещества и температурой газа. Он является основой для многих других законов и формул, используемых в химических расчетах.
Исторический обзор закона Клапейрона-Менделеева
Клапейроном было установлено, что для всех идеальных газов справедливо следующее уравнение:
pV = RT
где p — давление газа, V — его объем, R — универсальная газовая постоянная, T — температура газа в абсолютных единицах.
Менделеев открыл, что закон Клапейрона также применим и для газов, не являющихся идеальными. Он предположил, что если в уравнение Клапейрона добавить дополнительные коэффициенты, учитывающие действительное поведение газа, то оно будет справедливо и для неидеальных систем.
Таким образом, Менделеев сформулировал уравнение вида:
pV = ZRT
где Z — коэффициент сжимаемости, зависящий от давления и температуры. Иначе говоря, Закон Клапейрона-Менделеева позволяет учесть влияние действительных физических свойств газов при различных условиях.
Закон Клапейрона-Менделеева оказал огромное влияние на развитие химии и физики. Он позволил с бóльшей точностью и объективностью изучать свойства газов и применять их в различных областях науки и промышленности.
Роль Клапейрона в открытии закона
Роль Клапейрона в открытии закона состояла в его разработке и формулировке. Бельгийский ученый Бенуа Клапейрон в 1834 году опубликовал статью, в которой он вывел уравнение, описывающее зависимость между давлением и объемом газа при постоянной температуре. Затем в 1845 году французский химик Дмитрий Иванович Менделеев на основе работ Клапейрона и других ученых дополнил уравнение, учитывая зависимость от температуры.
Это открытие имело огромное значение для развития химии и физики. Закон Клапейрона-Менделеева позволяет описывать и предсказывать поведение газов и газовых смесей при различных условиях, а также упрощает проведение вычислений и экспериментов. Благодаря этому закону возможно изучение реакций, происходящих в газовой фазе, а также определение физико-химических свойств веществ.
Важность открытия закона Клапейрона-Менделеева подтверждается его широким применением в разных областях науки и техники. Закон используется для расчета рабочих параметров газовых систем, в дизайне криогенных установок, в анализе и моделировании процессов сжижения газа и многих других применений. Таким образом, роль Бенуа Клапейрона в открытии закона несомненно огромна и его вклад в науку долгое время будет оставаться значительным.
Открытие Менделеевым уравнения
Таким образом, Менделеев сформулировал уравнение, которое позволяет вычислить изменение объема газа при изменении температуры и давления. Оно было названо в его честь уравнением Менделеева или уравнением идеального газа.
Уравнение Менделеева выглядит следующим образом:
PV = nRT
- P — давление газа
- V — объем газа
- n — количество вещества газа
- R — универсальная газовая постоянная
- T — температура, измеренная в абсолютных единицах
Уравнение Менделеева позволяет решать различные задачи, связанные с идеальными газами, например, вычислять конечный объем газа, его давление или температуру.
Открытие уравнения Менделеевым имело огромное значение для развития физической химии. Оно помогло установить закономерности и связи между физическими величинами в системах с различными условиями. Это уравнение является основой для понимания и изучения многих явлений и процессов, происходящих в природе и промышленности.
Уравнение Клапейрона-Менделеева и его основные составляющие
Уравнение Клапейрона-Менделеева выглядит следующим образом:
PV = nRT
где P – давление газа, V – его объем, n – количество вещества (в молях), R – универсальная газовая постоянная, T – абсолютная температура газа.
Из данного уравнения можно вывести несколько важных следствий:
1. При постоянной температуре и количестве вещества, давление газа пропорционально его объему. Это значит, что при увеличении объема газа, его давление уменьшается, и наоборот.
2. При постоянном давлении и количестве вещества, объем газа прямо пропорционален его температуре. Если температура газа повышается, его объем увеличивается, и наоборот.
3. Уравнение позволяет вычислить количество вещества газа при известных параметрах (давление, объем, температура) или определить значения параметров при заданном количестве вещества. Это особенно полезно при проведении различных термодинамических расчетов.
Важно отметить, что уравнение Клапейрона-Менделеева применимо только для идеальных газов, то есть газов, у которых взаимодействие между частицами можно пренебречь. Для реальных газов, в которых межмолекулярные силы имеют существенное значение, уравнение требует дополнительных поправок.
Зависимость давления от объема и температуры
Закон Клапейрона-Менделеева описывает зависимость между давлением, объемом и температурой идеального газа. Согласно этому закону, давление идеального газа прямо пропорционально его абсолютной температуре и обратно пропорционально его объему.
Математически, закон Клапейрона-Менделеева может быть выражен уравнением:
PV = nRT
где:
- P — давление газа
- V — объем газа
- n — количество вещества газа (в молях)
- R — универсальная газовая постоянная
- T — абсолютная температура газа
Закон Клапейрона-Менделеева позволяет предсказывать изменение давления газа при изменении объема или температуры, при условии, что все остальные факторы остаются неизменными. Этот закон является фундаментальным составляющим термодинамики и широко используется в научных и инженерных расчетах.
Из уравнения Закона Клапейрона-Менделеева также можно заключить, что при постоянных значениях давления и температуры, объем идеального газа обратно пропорционален количеству вещества газа. Это объясняет явление сжимаемости газов и их возможность занимать любой объем.
Обратите внимание, что Закон Клапейрона-Менделеева является приближенным и не учитывает взаимодействия между молекулами газа.
Идеальные газы и ограничения уравнения
Уравнение состояния идеального газа, известное как уравнение Клапейрона-Менделеева, описывает связь между давлением, объемом и температурой газа.
Идеальный газ представляет собой газ, в котором молекулы не взаимодействуют друг с другом и занимают пространство без объема. В реальности существуют много газов, которые приближаются к поведению идеального газа при определенных условиях.
Уравнение Клапейрона-Менделеева имеет свои ограничения и не применимо для описания поведения реальных газов при всех условиях. В основе уравнения лежит предположение, что молекулы газа не взаимодействуют друг с другом, что не всегда соответствует действительности.
Кроме того, уравнение Клапейрона-Менделеева предполагает, что газ является идеальным во всех диапазонах давлений и температур. Однако, при высоких давлениях и низких температурах, газы могут проявлять дополнительные свойства, такие как конденсация и образование жидкости или твердого вещества, что не учитывается данным уравнением.
Учитывая эти ограничения, уравнение Клапейрона-Менделеева все же является полезным инструментом для описания поведения многих газов в широком диапазоне условий. Оно позволяет рассчитывать изменение давления, объема или температуры газа при известных значениях двух других параметров. Также уравнение может быть использовано для сравнения поведения различных газов при определенных условиях.
Применение закона Клапейрона-Менделеева в современной химии
Одним из основных применений закона Клапейрона-Менделеева является расчет состава газовых смесей. По этому закону можно определить мольную долю каждого газа в смеси, зная его давление, объем и температуру. Это важно при проведении различных химических реакций, где необходимо знать точные пропорции веществ.
Также закон Клапейрона-Менделеева используется для определения изменения состояния газа при изменении давления, объема или температуры. Это позволяет проводить расчеты и предсказывать изменения взаимодействий различных газов с окружающей средой.
Другим важным применением закона Клапейрона-Менделеева является расчет фазовых равновесий в различных системах. С его помощью можно определить точку, в которой газ перейдет в жидкую или твердую фазу, а также предсказать изменения при изменении условий окружающей среды.
Кроме того, закон Клапейрона-Менделеева находит применение в химической термодинамике. С его помощью можно определить изменение энтропии, энергии и других термодинамических параметров химических реакций.
Таким образом, закон Клапейрона-Менделеева имеет широкое применение в современной химии и является основой для понимания физических и химических свойств газов и их взаимодействия с окружающей средой.
Вопрос-ответ:
Как формулируется закон Клапейрона-Менделеева?
Закон Клапейрона-Менделеева устанавливает зависимость между давлением, объемом, температурой и количеством вещества газовой смеси. Он формулируется следующим образом: pV = nRT, где p — давление, V — объем, n — количество вещества, R — универсальная газовая постоянная, T — температура.
Какой физический смысл имеет уравнение Клапейрона-Менделеева?
Уравнение Клапейрона-Менделеева описывает зависимость между давлением, объемом, температурой и количеством вещества газовой смеси. Оно позволяет вычислять свойства газов и предсказывать их поведение при изменении этих параметров. Также уравнение позволяет определить взаимосвязь между различными физическими величинами, такими как объем и температура, или давление и количество вещества.
Какие условия должны соблюдаться для применения закона Клапейрона-Менделеева?
Для применения закона Клапейрона-Менделеева необходимо, чтобы газовая смесь была идеальной, то есть чтобы межмолекулярные взаимодействия и объем молекул были несущественными. Также необходимо, чтобы радиус молекул газа был много меньше размеров сосуда, в котором происходит измерение. Кроме того, условия эксперимента должны быть стабильными, то есть температура и давление должны быть постоянными в течение выполнения измерений.
Какую важную роль играет универсальная газовая постоянная в законе Клапейрона-Менделеева?
Универсальная газовая постоянная, обозначаемая символом R, играет важную роль в законе Клапейрона-Менделеева. Она представляет собой физическую константу, которая связывает между собой единицы измерений для давления, объема, температуры и количества вещества. Значение R зависит от выбранной системы единиц измерения и может быть выражено в различных единицах, таких как Па·м³/(моль·К) или Дж/(моль·К). Универсальная газовая постоянная также используется для вычисления различных физических величин, связанных с газами, и позволяет сравнивать различные газовые системы.
Что такое закон Клапейрона-Менделеева?
Закон Клапейрона-Менделеева — это физический закон, устанавливающий связь между давлением, объемом и температурой идеального газа. Закон формулируется уравнением PV = nRT, где P — давление, V — объем, T — температура, n — количество вещества газа, R — универсальная газовая постоянная. Уравнение позволяет вычислять изменение одной из величин, зная значения остальных.
Какую роль играет универсальная газовая постоянная в законе Клапейрона-Менделеева?
Универсальная газовая постоянная (R) входит в уравнение Клапейрона-Менделеева и является постоянной величиной. Она отражает отношение между объемом, давлением, температурой и количеством вещества газа. Значение универсальной газовой постоянной равно 8,314 Дж/(моль·К).
Какие вещества подчиняются закону Клапейрона-Менделеева?
Закон Клапейрона-Менделеева справедлив для идеальных газов, то есть газов, в которых межатомные взаимодействия минимальны. На практике этим условиям удовлетворяют воздух, азот, кислород, водород и некоторые другие газы при не слишком высоких давлениях и низких температурах.