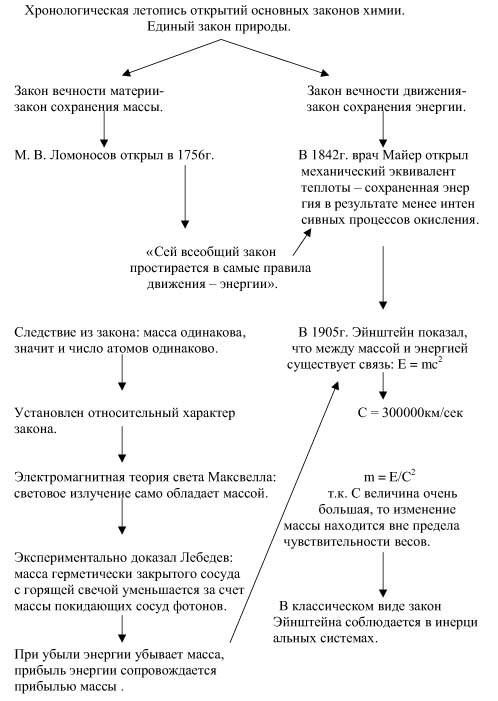
Закон сохранения массы и энергии – один из фундаментальных принципов в химии, который гласит, что во всех химических реакциях масса и энергия не могут быть созданы или уничтожены, а лишь превращены из одной формы в другую. Этот закон является основой для понимания и описания химических процессов и имеет широкое применение во многих областях науки и техники.
Идея о сохранении массы и энергии находит свое подтверждение во множестве опытов, проводимых в химической лаборатории. Например, при сжигании угля или древесины (химическая реакция окисления), в результате процесса выделяется большое количество тепла и образуется дым. Несмотря на это, суммарная масса продуктов сгорания остается неизменной: все, что выделяется в процессе реакции, поступает в окружающую среду или остается в виде остатков. Таким образом, закон сохранения массы и энергии оказывает важное влияние на промышленные процессы, включая сжигание топлива и производство химических веществ.
Принципы закона сохранения массы и энергии применимы также и в живой природе. В процессе пищеварения растений и животных углеводы, белки и жиры превращаются в энергию, которая затем используется для поддержания жизнедеятельности организмов. При этом масса тела остается постоянной, так как все пищевые продукты перерабатываются и экскретируются. Таким образом, закон сохранения массы и энергии играет важную роль в понимании механизмов обмена веществ в организмах живых существ.
Определение закона сохранения массы и энергии:
Это значит, что в процессе химических превращений атомы не могут исчезать или появляться, они могут только перераспределяться между веществами. Например, при смешении растворов двух веществ и последующем образовании осадка, масса и количество атомов вещества остаются теми же, только атомы перераспределяются между раствором и осадком.
Закон сохранения энергии утверждает, что энергия в системе также не создается и не уничтожается, а только преобразуется из одной формы в другую. Это означает, что сумма начальной и конечной энергии системы остается постоянной.
Закон сохранения массы и энергии является фундаментальным принципом, лежащим в основе большинства физических и химических процессов. Он позволяет предсказывать результаты реакций и анализировать изменения, происходящие в системе.
Примером применения закона сохранения массы является реакция сгорания. При сжигании древесины или другого органического вещества, в котором содержится углерод, вещества превращаются в диоксид углерода и воду. Масса древесины и суммарная масса продуктов сгорания будут равны, в соответствии с законом сохранения массы.
Примером применения закона сохранения энергии является горение газа. Когда газ горит, энергия, получаемая от сгорания, преобразуется в тепло и свет. Сумма начальной энергии газа и полученной энергии тепла и света остается постоянной, в соответствии с законом сохранения энергии.
Принципы закона сохранения массы:
Первый принцип закона сохранения массы заключается в том, что в химической реакции сумма масс веществ, участвующих в реакции, остается неизменной. Это означает, что масса продуктов реакции равна массе исходных веществ.
Второй принцип закона сохранения массы заключается в том, что химическая реакция не создает или не уничтожает массу. Вещества могут претерпевать химические изменения, но их масса остается неизменной.
Третий принцип закона сохранения массы заключается в том, что в химической реакции масса реагирующих веществ равна массе образующихся продуктов. Это значит, что каждый атом или молекула реагирующего вещества сохраняются в продуктах реакции.
Принципы закона сохранения массы играют важную роль при расчетах химических реакций и позволяют предсказывать массу продуктов реакции на основе массы исходных веществ.
Принципы закона сохранения энергии:
Принципы закона сохранения энергии следующие:
1. Закрытая система. Закон сохранения энергии справедлив только в закрытой системе, где энергия не может входить или выходить из системы. В такой системе сумма потенциальной и кинетической энергии остается постоянной.
2. Потенциальная и кинетическая энергия. Закон сохранения энергии утверждает, что сумма потенциальной и кинетической энергии в системе остается постоянной во времени. Если потенциальная энергия увеличивается, то кинетическая энергия уменьшается и наоборот.
3. Силы и работа. Закон сохранения энергии также связан с работой и силами, действующими на систему. Если на систему действуют силы, совершающие работу, то энергия переходит из одной формы в другую, но сумма энергии остается неизменной.
4. Потери энергии. Обычно в реальных системах имеются потери энергии в виде тепла или трения, которые приводят к уменьшению общей энергии системы. Однако, учет этих потерь позволяет приближенно применять закон сохранения энергии.
Закон сохранения энергии является фундаментальным принципом в науке и используется во многих областях, включая химические реакции. Понимание и применение этого закона позволяет анализировать и предсказывать изменения в энергетическом состоянии системы.
Примеры проявления закона сохранения массы и энергии:
Закон сохранения массы и энергии служит основой для объяснения многих химических явлений. Вот несколько примеров, которые иллюстрируют его действие:
1. Реакции сгорания. При сгорании вещества масса продуктов реакции остается равной массе исходных реагентов. Например, при сгорании бензина (C8H18) в кислороде (O2) образуется углекислый газ (CO2) и вода (H2O), при этом суммарная масса продуктов реакции равна массе исходных реагентов.
2. Электрохимические реакции. В электрохимических реакциях, таких как электролиз и гальваническая ячейка, закон сохранения массы и энергии также соблюдается. В электролизе, например, при разложении воды на атомы водорода и кислорода, масса образовавшихся газов соответствует массе исходной воды.
3. Ядерные реакции. В ядерных реакциях масса ядерных частиц также сохраняется. Например, при делении ядер атома урана или плутония масса продуктов реакции остается равной массе исходных атомов. Это принципиально важно для работы ядерных реакторов.
Таким образом, примеры проявления закона сохранения массы и энергии в химии подтверждают его универсальность и справедливость в различных химических процессах.
Процессы химических реакций:
Химические реакции можно классифицировать в зависимости от различных факторов, включая скорость реакции, условия происхождения и причины реакции.
Одной из основных характеристик химической реакции является энергетический баланс. Процесс химической реакции может включать либо выделение энергии (экзотермический процесс), либо поглощение энергии (эндотермический процесс).
Скорость процесса является ещё одним важным параметром. Она может быть быстрой или медленной в зависимости от условий, веществ участвующих в реакции и концентраций реагентов.
Процессы химических реакций играют ключевую роль во многих областях науки и промышленности. Химические реакции позволяют получать новые материалы, эффективно использовать энергию и синтезировать различные соединения.
Физические явления:
Физические явления в химии включают в себя такие процессы, как изменение агрегатного состояния вещества, перемещение частиц, изменение давления и температуры.
Одним из физических явлений является плавление — процесс перехода вещества из твердого состояния в жидкое под воздействием повышения температуры. При этом масса вещества сохраняется, а его форма и объем меняются.
Другим физическим явлением является кипение — процесс перехода жидкости в газообразное состояние при нагревании до определенной температуры, называемой точкой кипения. При кипении молекулы вещества становятся настолько подвижными, что они начинают переходить в газообразное состояние и образуют пары.
Третьим физическим явлением является сублимация — переход вещества из твердого в газообразное состояние без промежуточного перехода в жидкое состояние. При сублимации вещество нагревается до определенной температуры, называемой точкой сублимации, и переходит в газообразное состояние.
Другие физические явления в химии включают диффузию, сорбцию, конденсацию и испарение. Все эти процессы подчиняются закону сохранения массы и энергии, согласно которому масса и энергия в системе остаются постоянными.
Примеры из повседневной жизни:
Закон сохранения массы и энергии имеет применение не только в химических реакциях, но и в нашей повседневной жизни. Вот несколько примеров, которые мы можем наблюдать вокруг нас:
1. Горение дров в камине: При горении дров энергия, содержащаяся в древесине, превращается в тепло и свет. Хотя дрова сгорают, их масса остается неизменной.
2. Зарядка мобильного телефона: При зарядке мобильного телефона энергия, поступающая от электрической розетки, превращается в энергию, необходимую для зарядки батареи. Масса телефона также не изменяется.
3. Реакция кислорода с горючим: В процессе горения наиболее распространенным примером является реакция кислорода с топливом. Например, при горении бензина в двигателе автомобиля энергия, содержащаяся в бензине, превращается в тепло и движение, но общая масса остается неизменной.
4. Фотосинтез растений: В фотосинтезе растения преобразуют солнечную энергию в химическую энергию, которая затем используется для роста и развития. В этом процессе углекислый газ и вода превращаются в глюкозу и кислород, но масса остается постоянной.
Эти примеры показывают, как закон сохранения массы и энергии является универсальным принципом и применим не только в химии, но и в различных ситуациях в нашей повседневной жизни.
Вопрос-ответ:
Что такое закон сохранения массы и энергии в химии?
Закон сохранения массы и энергии в химии утверждает, что в химической реакции общая масса всех реагентов равна общей массе всех продуктов реакции. Это означает, что масса вещества не создается и не уничтожается в химической реакции, а только преобразуется из одной формы в другую.
Как применяется закон сохранения массы и энергии в химии?
Закон сохранения массы и энергии используется в химии для подсчета количества вещества, участвующего в реакции, и определения массы продуктов реакции. Этот закон также помогает установить соотношение между массами реагентов и продуктов реакции, что необходимо для правильной формулировки химических уравнений.
Можно ли нарушить закон сохранения массы и энергии в химии?
Нет, нельзя нарушить закон сохранения массы и энергии в химии. Этот закон является одним из фундаментальных принципов природы и подтверждается множеством экспериментальных данных. Все химические реакции, которые происходят в природе или в лабораторных условиях, соблюдают этот закон.
Зачем нужен закон сохранения массы и энергии в химии?
Закон сохранения массы и энергии в химии является одним из основных принципов, которые служат основой для понимания химических реакций и процессов. Он гласит, что в химической реакции масса и энергия не могут быть созданы или уничтожены, а только преобразованы из одной формы в другую. Этот закон позволяет устанавливать соотношения между массой реагентов и продуктов реакции, а также рассчитывать энергетические изменения, происходящие в результате химической реакции.
Может ли масса и энергия изменяться во время химической реакции?
Нет, закон сохранения массы и энергии утверждает, что масса и энергия не могут быть созданы или уничтожены во время химической реакции. В процессе химической реакции масса реагентов равна массе продуктов, а энергия, выделяющаяся или поглощаемая в результате реакции, равна энергии, поглощенной или выделенной реагентами. Таким образом, закон сохранения массы и энергии позволяет предсказывать результаты химических реакций и рассчитывать энергетические изменения, происходящие в процессе.